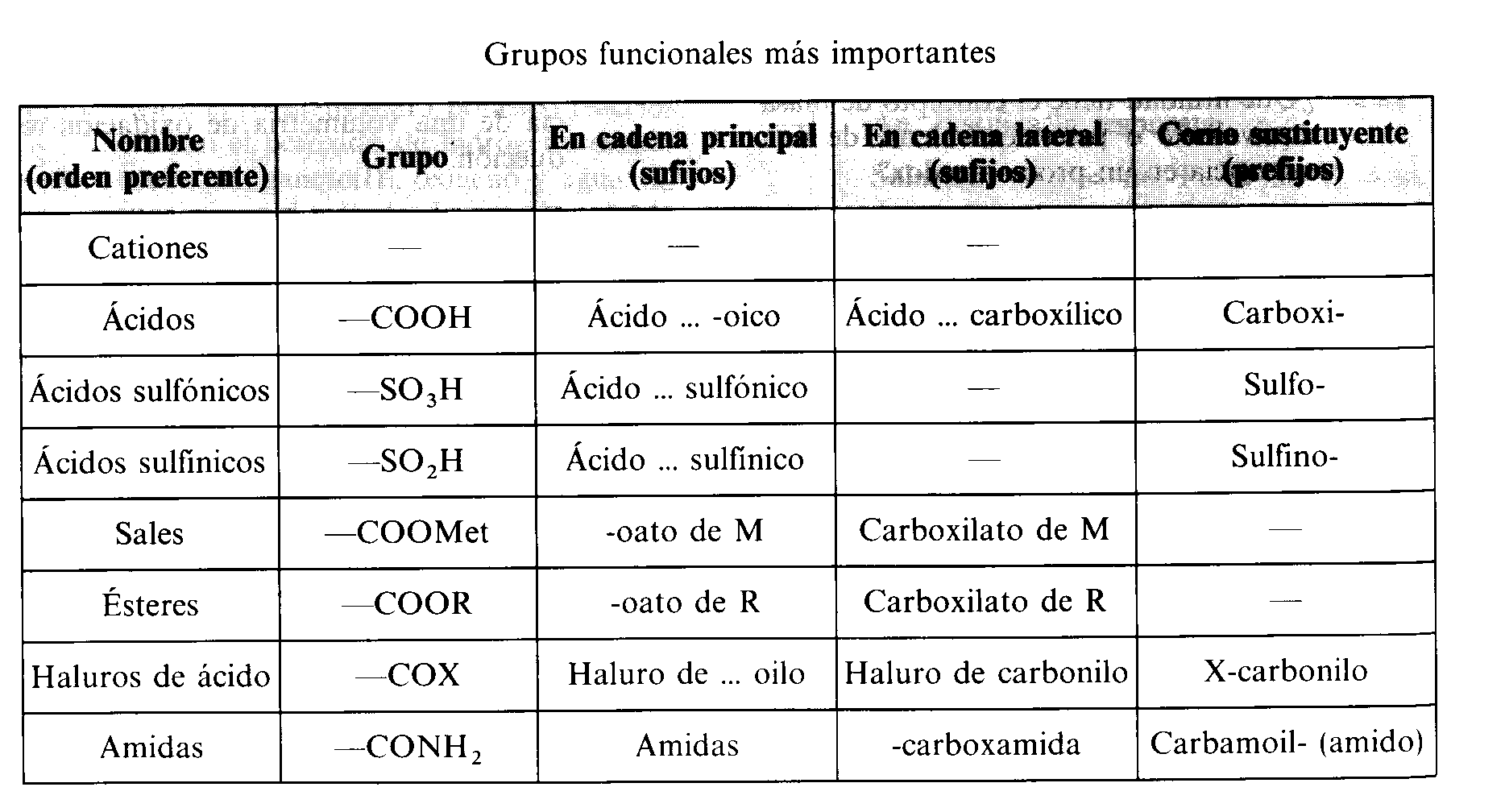
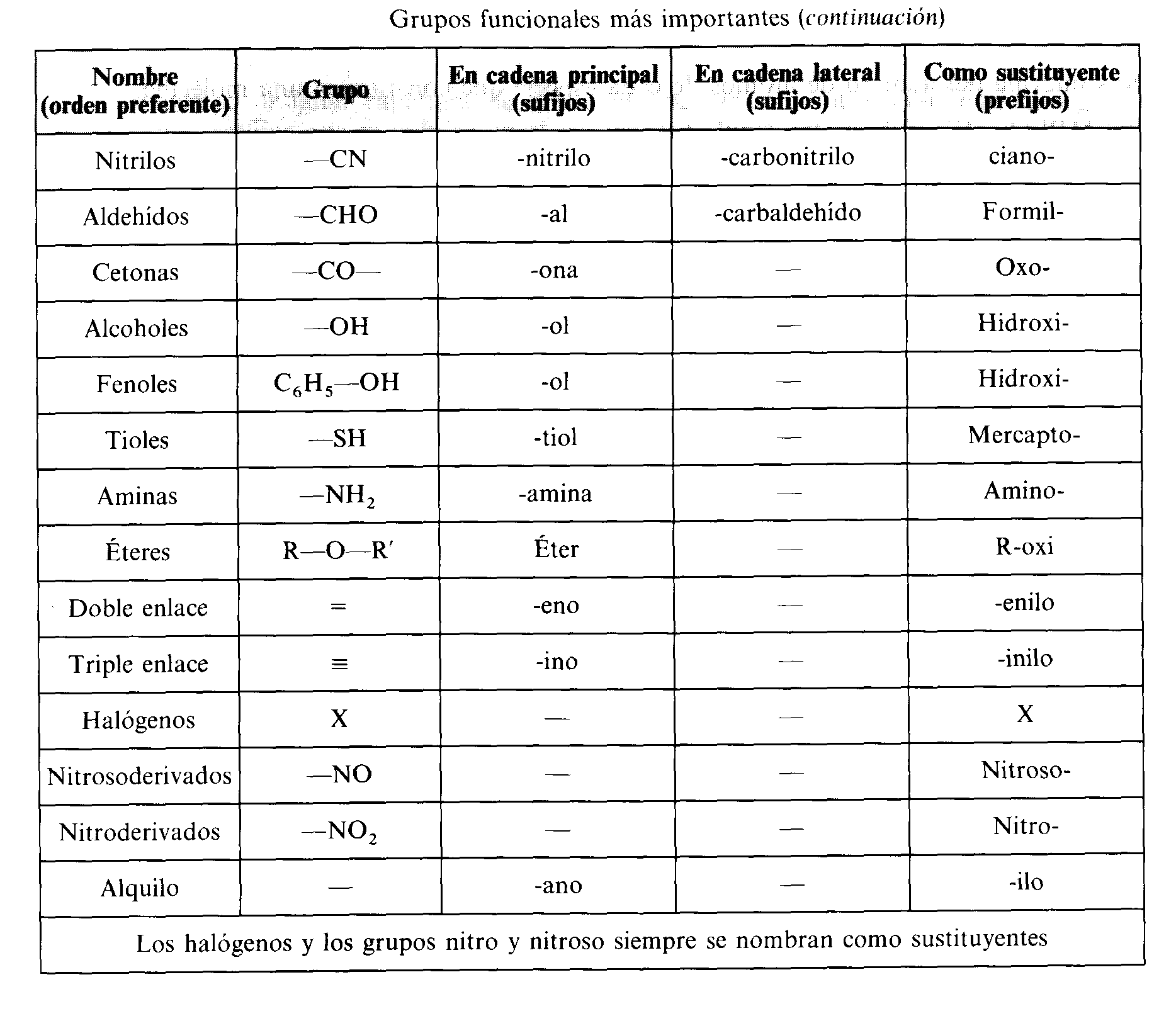
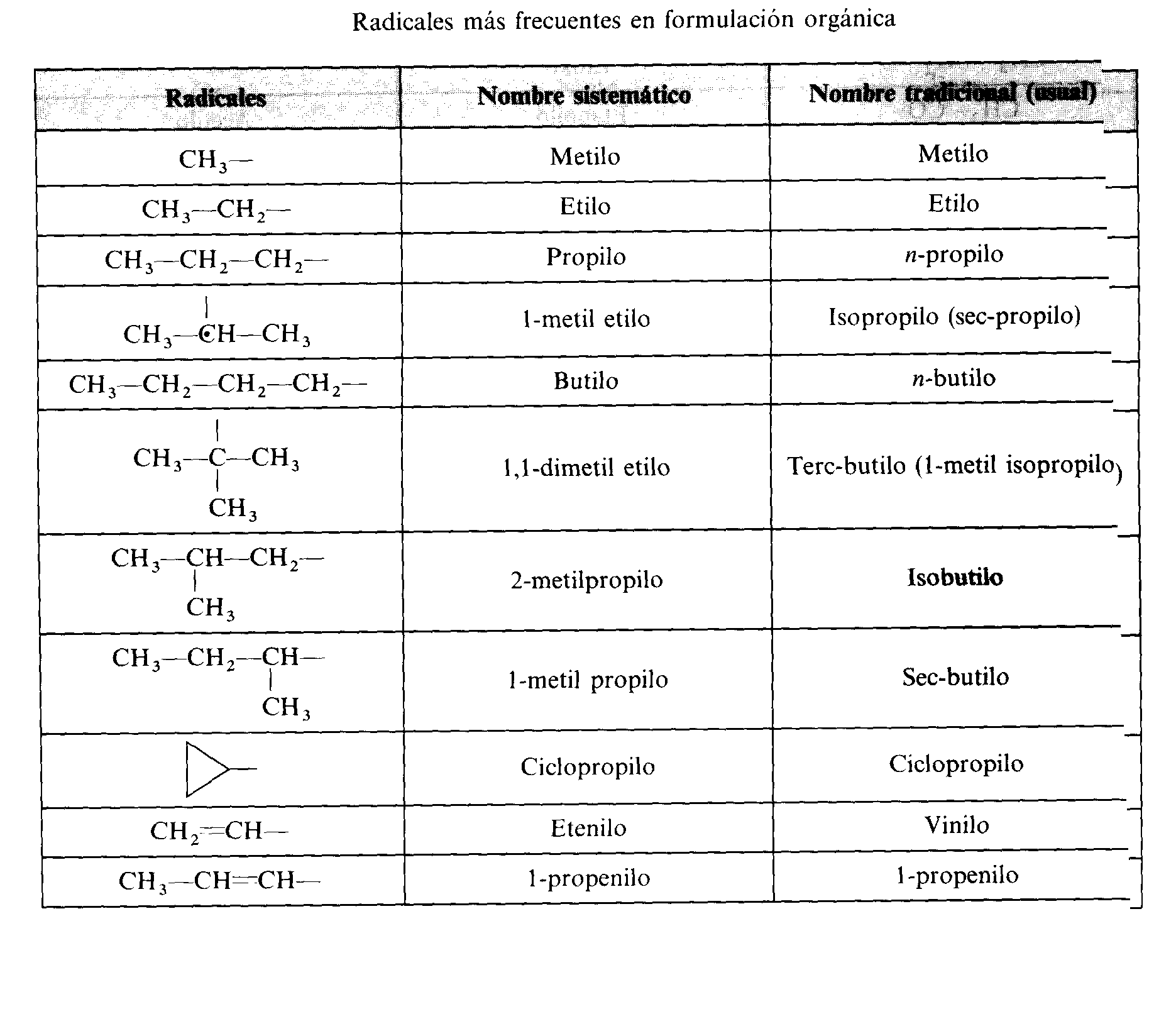
¿Qué son los polímeros?
La materia esta formada por
moléculas que pueden ser de tamaño normal o moléculas gigantes llamadas
polímeros.
Los polímeros se producen por la
unión de cientos de miles de moléculas pequeñas denominadas monómeros que
forman enormes cadenas de las formas más diversas. Algunas parecen fideos,
otras tienen ramificaciones. algunas más se asemejan a las escaleras de mano y
otras son como redes tridimensionales.
Existen polímeros naturales de
gran significación comercial como el algodón, formado por fibras de celulosas.
La celulosa se encuentra en la madera y en los tallos de muchas plantas, y se
emplean para hacer telas y papel. La seda es otro polímero natural muy
apreciado y es una poliamida semejante al nylon. La lana, proteína del pelo de
las ovejas, es otro ejemplo. El hule de los árboles de hevea y de los arbustos
de Guayule, son también polímeros naturales importantes.
Sin embargo, la mayor parte de
los polímeros que usamos en nuestra vida diaria son materiales sintéticos con
propiedades y aplicaciones variadas.
Lo que distingue a los polímeros
de los materiales constituídos por moléculas de tamaño normal son sus propiedades
mecánicas. En general, los polímeros tienen una excelente resistencia mecánica
debido a que las grandes cadenas poliméricas se atraen. Las fuerzas de
atracción intermoleculares dependen de la composición química del polímero y
pueden ser de varias clases.
Fuerzas de Van der Waals.
También llamadas fuerzas de
dispersión, presentes en las moléculas de muy baja polaridad, generalmente
hidrocarburos. Estas fuerzas provienen de dipolos transitorios: como resultado
de los movimientos de electrones, en cierto instante una porción de la molécula
se vuelve ligeramente negativa, mientras que en otra región aparece una carga
positiva equivalente. Así se forman dipolos no-permanentes. Estos dipolos
producen atracciones electroestáticas muy débiles en las moléculas de tamaño
normal, pero en los polímeros, formados por miles de estas pequeñas moléculas,
las fuerzas de atracción se multiplican y llegan a ser enormes, como en el caso
del polietileno.
En la tabla 1.1 se observa como
cambian la densidad y la temperatura de fusión, al aumentar el número de átomos
de carbono en la serie de los hidrocarburos. Los compuestos más pequeños son
gases a la temperatura ambiente. al aumentar progresivamente el número de
carbonos, los compuestos se vuelven líquidos y luego sólidos, cada vez con
mayor densidad y mayor temperatura de fusión, hasta llegar a los polietilenos
con densidades que van de 0,92 a 0, 96 g / cm3 y temperaturas de fusión entre
105 y 135° C.
|
Hidrocarburo
|
Fórmula
|
Peso molecular
|
Densidad
|
T. de fusión
|
|
Metano
|
CH4
|
16
|
gas
|
-182 °C
|
|
Etano
|
C2H6
|
30
|
gas
|
-183 °C
|
|
Propano
|
C3H8
|
44
|
gas
|
-190 °C
|
|
butano
|
C4H10
|
58
|
gas
|
-138 °C
|
|
Pentano
|
C5H12
|
72
|
0,63
|
-130 °C
|
|
Hexano
|
C6H14
|
86
|
0,66
|
-95 °C
|
|
Heptano
|
C7H16
|
100
|
0,68
|
-91 °C
|
|
Octano
|
C8H18
|
114
|
0,70
|
-57 °C
|
|
Nonano
|
C9H20
|
128
|
0,72
|
-52 °C
|
|
Decano
|
C10H22
|
142
|
0,73
|
-30 °C
|
|
Undecano
|
C11H24
|
156
|
0,74
|
-25 °C
|
|
Dodecano
|
C12H26
|
170
|
0,75
|
-10 °C
|
|
Pentadecano
|
C15H32
|
212
|
0,77
|
10 °C
|
|
Eicosano
|
C20H42
|
283
|
0,79
|
37 °C
|
|
Triacontano
|
C30H62
|
423
|
0,78
|
66 °C
|
|
Polietileno
|
C2000H4002
|
28000
|
0,93
|
100 °C
|
Densidad
y temperatura de fusión de hidrocarburos.
Fuerzas de atracción.
Debidas a dipolos permanentes,
como en el caso de los poliésteres. Estas atracciones son mucho más potentes y
a ellas se debe la gran resistencia tensil de las fibras de los poliésteres.
Enlaces de hidrógeno.
Como en las poliamidas (nylon).
Estas interacciones son tan
fuertes, que una fibra obtenida con estas poliamidas tiene resistencia tensil
mayor que la de una fibra de acero de igual masa.
Otros polímeros.
Hay atracciones de tipo iónico
que son las más intensas:
Un ejemplo sería el copolímero
etileno-ácido acrílico, que al ser neutralizado con la base M(OH)2, producirá
la estructura indicada. Estos materiales se llaman ionómeros y se usan, por
ejemplo, para hacer películas transparentes de alta resistencia.
|
Tipo de enlace
|
Kcal / mol
|
|
Van der
Waals en CH4
|
2,4
|
|
Dipolos
permanentes
|
3 a 5
|
|
Enlaces
hidrógeno
|
5 a 12
|
|
Iónicos
|
mayores
a 100
|
Energía
requerida para romper cada enlace.
La fuerza total de atracción
entre las moléculas del polímero, dependería del número de las interacciones.
Como máximo, sería igual a la energía de enlace según la tabla, multiplicada
por el número de átomos de carbono en el caso del polietileno o por el número
de carbonílicos C = O en los poliésteres, etc. rara vez se alcanza este valor
máximo, porque las cadenas de los polímeros no pueden, por lo general,
acomodarse con la perfección que sería requerida.
Concepto y clasificación.
Un polímero (del griego poly,
muchos; meros, parte, segmento) es una sustancia cuyas moléculas son, por lo
menos aproximadamente, múltiplos de unidades de peso molecular bajo. La unidad
de bajo peso molecular es el monómero. Si el polímero es rigurosamente uniforme
en peso molecular y estructura molecular, su grado de polimerización es
indicado por un numeral griego, según el número de unidades de monómero que
contiene; así, hablamos de dímeros, trímeros, tetrámero, pentámero y sucesivos.
El término polímero designa una combinación de un número no especificado de
unidades. De este modo, el trióximetileno, es el trímero del formaldehído, por
ejemplo.
Si el número de unidades es muy
grande, se usa también la expresión gran polímero. Un polímero no tiene la
necesidad de constar de moléculas individuales todas del mismo peso molecular,
y no es necesario que tengan todas las mismas composiciones químicas y la misma
estructura molecular. Hay polímeros naturales como ciertas proteínas globulares
y policarbohidratos, cuyas moléculas individuales tienen todos los mismos pesos
moleculares y la misma estructura molecular; pero la gran mayoría de los
polímeros sintéticos y naturales importantes son mezclas de componentes
poliméricos homólogos. La pequeña variabilidad en la composición química y en
la estructura molecular es el resultado de la presencia de grupos finales,
ramas ocasionales, variaciones en la orientación de unidades monómeras y la
irregularidad en el orden en el que se suceden los diferentes tipos de esas
unidades en los copolímeros. Estas variedades en general no suelen afectar a
las propiedades del producto final, sin embargo, se ha descubierto que en
ciertos casos hubo variaciones en copolímeros y ciertos polímeros cristalinos.
Polímeros isómeros.
Los polímeros isómeros son polímeros
que tienen escencialmente la misma composición de porcentaje, pero difieren en
la colocación de los átomos o grupos de átomos en las moléculas. Los polímeros
isómeros del tipo vinilo pueden diferenciarse en las orientaciones relativas
(cabeza a cola, cabeza a cabeza, cola a cola, o mezclas al azar de las dos.) de
los segmentos consecutivos (unidades monómeras.).:
Cabeza a cola
—CH2—CHX—CH2—CHX—CH2—CHX—CH2—CHX—
Cabeza a cabeza y
cola a cola
— CH2—CH2—CHX—CHX—CH2—CH2—CHX—CHX—CH2—
O en la orientación de
sustituyentes o cadenas laterales con respecto al plano de la cadena axial
hipotéticamente extendida.
La isomería cis-trans puede
ocurrir, y probablemente ocurre, para cualquier polímero que tenga ligaduras
dobles distintas a las que existen en los grupos vinilo pendientes (los unidos
a la cadena principal).
Concepto de tacticidad.
El termino tacticidad se refiere
al ordenamiento espacial de las unidades estructurales.
El mejor ejemplo es el
polipropileno, que antes de 1.955 no tenía ninguna utilidad. En ese año, Giulio
Natta en Milán, utilizó para hacer polipropileno, los catalizadores que Karl
Ziegler había desarrollado para el polietileno. Esos catalizadores, hechos a
base de cloruro de titanio y tri-alquil-aluminio, acomodan a los monómeros de
tal manera que todos los grupos metilos quedan colocados del mismo lado en la
cadena.
En esta forma, Natta creó el
polipropileno isotáctico, que tiene excelentes propiedades mecánicas. Hasta ese
momento, con los procedimientos convencionales, sólo se había podido hacer
polímeros atácticos, sin regularidad estructural.
El polipropileno atáctico es un
material ceroso, con pésimas propiedades mecánicas.
Otros catalizadores permiten
colocar los grupos alternadamente, formando polímeros que se llaman
sindiotácticos, los cuales, como los isotácticos, tienen muy buenas
propiedades.
Homopolímeros y copolímeros.
Los materiales como el
polietileno, el PVC, el polipropileno, y otros que contienen una sola unidad
estructural, se llaman homopolímeros. Los homopolímeros, a demás, contienen
cantidades menores de irregularidades en los extremos de la cadena o en
ramificaciones.
Por otro lado los copolímeros
contienen varias unidades estructurales, como es el caso de algunos muy
importantes en los que participa el estireno.
Estas combinaciones de monómeros
se realizan para modificar las propiedades de los polímeros y lograr nuevas
aplicaciones. Lo que se busca es que cada monómero imparta una de sus
propiedades al material final; así, por ejemplo, en el ABS, el acrilonitrilo
aporta su resistencia química, el butadieno su flexibilidad y el estireno
imparte al material la rigidez que requiera la aplicación particular.
Evidentemente al variar las
proporciones de los monómeros, las propiedades de los copolímeros van variando
también, de manera que el proceso de copolimerización permite hasta cierto
punto fabricar polímeros a la medida.
No solo cambian las propiedades
al variar las proporciones de los monómeros, sino también al variar su posición
dentro de las cadenas. Así, existen los siguientes tipos de copolímeros.
Las mezclas físicas de polímeros,
que no llevan uniones permanentes entre ellos, también constituyen a la enorme
versatilidad de los materiales poliméricos. Son el equivalente a las aleaciones
metálicas.
En ocasiones se mezclan para
mejorar alguna propiedad, aunque generalmente a expensas de otra. Por ejemplo,
el óxido de polifenilo tiene excelente resistencia térmica pero es muy difícil
procesarlo. El poliestireno tiene justamente las propiedades contrarias, de
manera que al mezclarlos se gana en facilidad de procedimiento, aunque resulte
un material que no resistirá temperaturas muy altas.. Sin embargo en este caso
hay un efecto sinergístico, en el sentido en que la resistencia mecánica es
mejor en algunos aspectos que a la de cualquiera de los dos polímeros. Esto no
es frecuente, porque puede ocurrir únicamente cuando existe perfecta
compatibilidad ente los dos polímeros y por regla general no la hay, así que en
la mayoría de los casos debe agregarse un tercer ingrediente para
compatibilizar la mezcla. Lo que se emplea casi siempre es un copolímero
injertado, o uno de bloque que contenga unidades estructurales de los dos
polímeros.
Otras veces se mezcla simplemente
para reducir el costo de material.
En otros casos, pequeñas cantidades
de un polímero de alta calidad puede mejorar la del otro, al grado de permitir
una nueva aplicación.